Orqanizmda dəmir metabolizması
Dəmir elektron transportu üçün esansial bir elementdir və oksigen transportu, mitoxondrial tənəffüs, zərərli oksigen radikalların inaktivasyonu və DNT sintezi üçün vacibdir. Bədəndə həddindən çox miqdarda dəmir toplanması xüsusən qaraciyərdə, pankreas və digər endokrin orqanlar da və ürək başda olmaqla müxtəlif orqan və sistemləri zədələyə bilər. Dəmirin funksiyaları, daşınması və toplanması zamanı hüceyrələrdə və bədən mayesində daima iki oksidasyon vəziyyətdə Ferrik (Fe+3) vəya ferroz (Fe+2) şəklində olur. Dəmirin bu elekron dəyişimi, redoks aktivitesi, bir tərəfən çox vacib və lazımlı olduğu halda, digər tərəfdən dəmirin çox toplanması nəticəsində əmələ gələn sərbəst dəmir sərbəst oksigen radikallarının yaranmasına səbəb olur. Antioksidantlar tərəfindən kifayət qədər detoksikasiya edilə bilməyən sərbəst oksigen radikalları hüceyrə elementləri üçün çox zərərli və toksikdir. Buna görə dəmir heç zaman sərbəst olmamağına çalışılır. Transferinlə daşınır, ferritində depolanır və orqanizmdə dəmir elementi çox nəzarət altında saxlanılır.
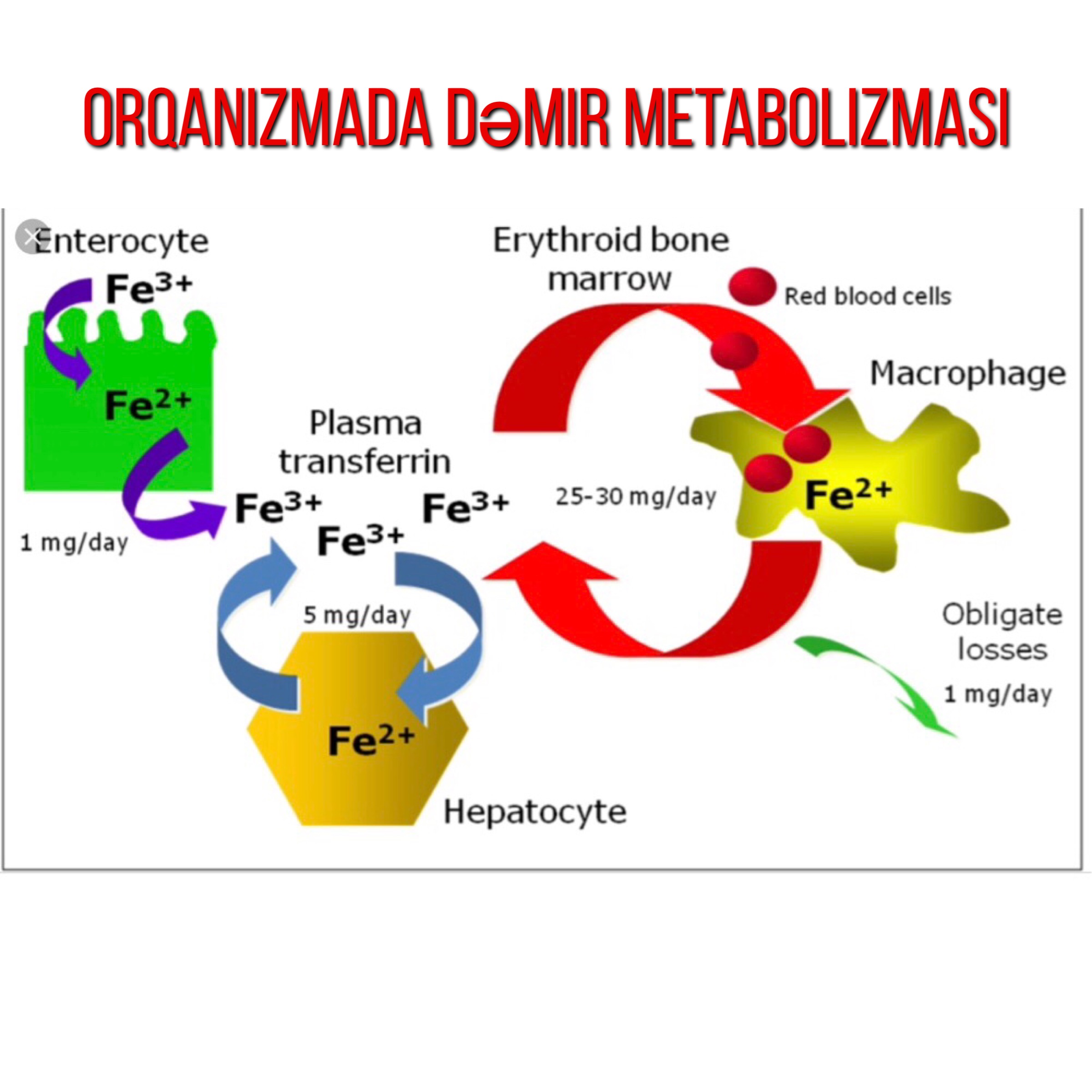
Orqanizmdə olan dəmirin 60 – 70% i hemoqlobində və dolaşan eritrositlərdə, 10% isə mioqlobin, sitoxrom və tərkibində dəmir olan fermentlərdədir. Qalan 20- 30% isə əsas qaraciyərdə və RES makrofaqlarda depolanır. Orqanizmadan dəmir atan normal fiziolojik bir mexanizma yoxdur. Gastrointestinal sistemdən tökülən epitel hüceyrələrlə və qanamalar xaricində dəmir itkisi olmaz. Fazlası toksik olan bu elementin sistemik dengesi tamamen emilimin kontrolu ile sağlanmaktadır.
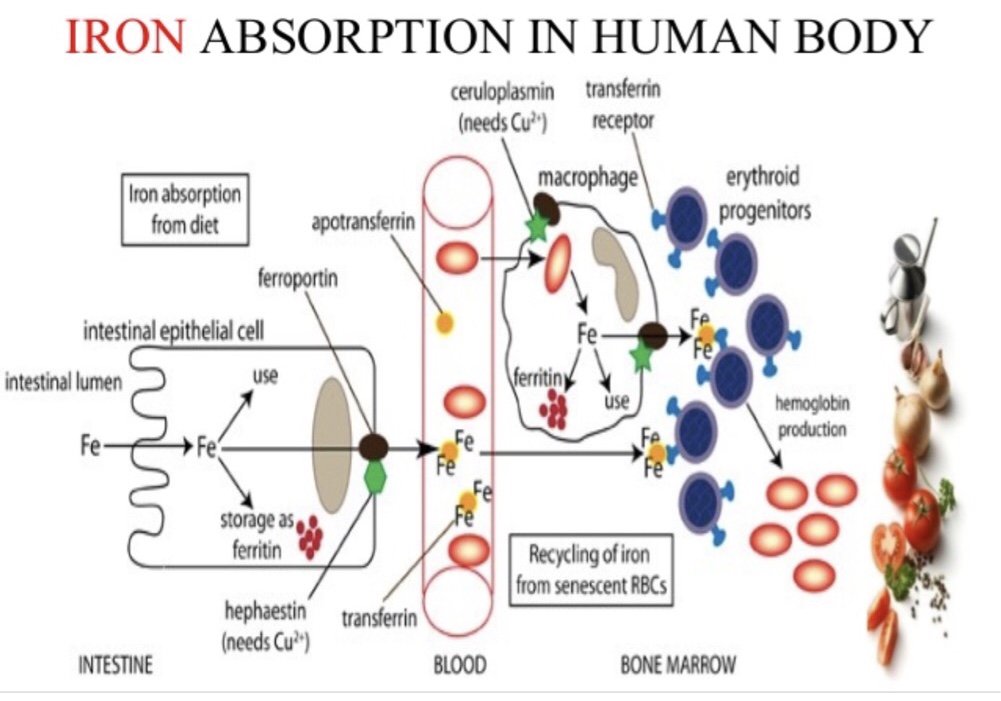
Dəmir dietada hemoqlobin və mioqlobinlə zəngin olan orqanik hem dəmir və mənbəsi ət olmayan inorqanik dəmir olmaq üzərə iki yerə bölünür. Ət yeməklə alınan hem dəmir və ət olmayan məhsullardan alınan inorqanik dəmirlərin orqanizmdə sorulma yolları tamamilə fərqlidir. Hem dəmiri ferroz (Fe +2) formda olub, dəmir çatışmazlığında sorulma 2-3 dəfəyə qədər artır. Hem, duodenal enterosite hem daşıyıcı protein 1 adlandırılan xüsusi daşıyıcı ilə girər. Hem xarici dəmirin sorulması (Fe+3) dəmir şəklində olub, duodenal sitoxrom b tərəfindən reduktə olunaraq ferroz şəklə çevrilir və divalan metal transporter 1 ilə enterosit içinə daxil olur. Enterositə alınan dəmirin bir qismi ferritin şəklinə toplanır və duodenal eksfoliasyon ilə atılır. Orqanizmaya dəmir alınacaqsa, əgər ehtiyac varsa, absorbsiya olunduqdan sonra enterositin bazolateral tərəfinə daşınır və ordan da insanda bilinən tək dəmir atıcısı olan ferroportin ilə plazmadakı transferinə yüklənir. Amma ilkin öncə Fe2+ Fe3+ halına oksidə edilir. Seruloplazmin homoloqu və bir transmembran proteini olan hefastin ile Fe +2, Fe+3 haline okside edilir.
Demir, plazmada karacigerden sentezlenen ve glikoprotein yapısında olan transferin tarafından taşınır Enterositin bazolateral tarafından ferroportin ile dışarı verilen ve hefastin ile okside edilerek ferrik (Fe+3) hale getirildikten sonra transferine yüklenen demir, portal dolaşımdan çoğu kemik iliğinde eritrosit öncü hücreleri olmak üzere hücrelere taşınır . Her transferin molekülü iki tane Fe+3 ü güçlü bir şekilde bağlar.
Hücreler tipine göre demiri farklı yollardan alırlar. Diyet demiri enterosit tarafından apikal tarafta bulunan DMT1 ile alınırken, makrofajlar önce fagosite ettikleri sirküle eden yaşlı eritrositlerdeki hemoglobinden demir alırlar. Makrofaqların vakuolar membranlarından demir transportu yine DMT1 ile olmaktadır.
Makrofajlarda açığa çıkan demir ya tekrar orqanizmada dolaşan demir olması için makrofaq ferroportini ile plazmaya verilmekte ya da makrofaq içinde ferrritin şeklinde depolanmaktadır. Ferroportin enterositte olduğu gibi hücrenin tek demir atıcısıdır. Bunlar dışında tüm hücreler demiri yüzeylerinde bulunan transferin reseptörlerini kullanarak plazma transferrininden almaktadırlar.
Orqanizmada demir homeostazındakı bozukluk başlıca iki mekanizma ile oluşmaktadır. Bu mekanizmalar hemakromatozis ve kronik hipokside olduğu gibi gastrointestinal sistemden artmış demir emilimi, ve β-talassemi, orak hücreli anemi ve myelodisplastik sendromda olduğu gibi anemiyi düzeltmek için yapılan transfüzyonlara bağlı demir yüklenmesidir.

Son yıllarda yapılan çalışmalar sonucunda orqanizma demir dengesini iki reqülatorun kontrol ettiği anlaşılmışdır. Eritropoetik ve depo reqülatorları olmak üzere. Eritropoetik reqülator, kemik iliğinden gelen sinyallerle çalışmaktadır. Eritropoetik aktivitenin çok arttığı durumlarda artan eritropoezin demir ihtiyacını karşılamak için, depolar dolu da olsa intestinal demir emilimi olmaktadır. Depo reqülatorü, karaciğer, iskelet kası ve dolaşan kandakı demir miktarı azaldığında bunu hissederek emilimi artıran bir reqülatordur. Eritropoetik reqülator depo reqülatorüne göre 20 kat fazla aktif demir emilimi sağlamaktadır. Bu nedenle talasemi intermediada orqanizma demir fazlalığı olduğu halde intestinal demir emilimi fazladır.
Enterosit absorbe edilen demiri depolar ve eritropoez hızı dışında, hipoksi, inflamasyon ve gebelik gibi çeşitli faktorlerden de etkilenmektedir.
Demir metabolizmasını düzenleyen ana molekül hepsidindir. Hepsidin esas olarak karaciğerden sentezlenen, dolaşımda bulunan ve idrarla atılan bir peptid hormon olup sistemik demir dengesinin ana düzenleyicisidir. Hepsidin ince barsakdan demir emilimini azaltır, makrofajlar tarafından yaşlı eritrositlerden çıkarılan ve tekrar plazmaya verilen demirin makrofaj çıkışını ve plazmaya verilmesini ve hepatik depolardan demir mobilizasyonunu engeller.
Eritropoetik aktivite artışı, hipoksi, orqanizma demir depolarının azalması durumlarında hepatik hepsidin sentezi azalır. Hepsidinin demir metabolizmasına negatif etkisi ve hipoferritinemi oluşturması yanında in vitro olarak eritroid öncü hücrelerin proliferasyonlarını ve yaşam sürelerini de azalttığı, eritropoezi bozduğu da gösterilmişdir.
Hemakromatoziste ve talasemi gibi anemilerde hepsidin agonistleri kullanılmasının, demir emilimini engellemek ve demirin kalp hücrelerine ve hepatositlere birikmesi yerine daha az toksik şekli olan makrofajların içinde tutmak için yararlı olacağı düşünülmektedir.

Çalışmalar hepsidin ile kronik infeksion ve inflamasyon arasındakı bağı da daha güclü olarak ortaya koymaya başlamışdır. Nemeth ve arkadaşları özellikle kronik infeksion ve ya ağır inflamasyon olgularında idrarda hepsidin düzeylerini incelemiş ve hafif olgulara göre daha ağır inflamasyon bulgusu olanlarda hepsidin düzeylerinde 100 kata varan farklılıklar saptamışlardır. Yine insan karaciğer hücreleriyle yapılan çalışmalarda hepsidin düzeylerinin lipopolisasakkaridlerle (LPS) ciddi şekilde uyarıldığını, LPS ile temas eden ve monositler tarafından salgılanan monokinlerin çok güçlü bir şekilde hepsidini uyardığını ortaya koymuşdur. Tüm bu çalışmalar sonucu inflamasyon sonucu artan hepsidin ekspersyonun demior açlığı yaparak eritropoezi baskılanmasının kronik inflamasyona bağlı anemi patogenezinde önemli bir rolu olduğunu ortaya koymaktadır. Özellikle, hemolitik anemilerde demir depolarının artışına rağmen hepsidininin baskılandığı ve eritropoezin hepsidin üzerine demir depolarının varlığından daha etkili bir uyaran olduğu da gösterilmiştir.
Ineffektif eritropoez ile seyreden hastalıklardan biri olan talasemi majorlü hastaların serumlarında hepsidin düzeyinin çok düşük olduğu saptanmışdır. Yine konjenital diseritropoetik anemi tip 1 tanısıyla izlenen 17 hastanın serumlarında hepsidin sentezinin baskılanmış olduğu saptanmışdır. Her iki durumda da serum GDF 15 ( growth differentiation factor) düzeyleri kontrollerle karşılaştırıldığında çok yüksek oranda sentezlendiği bildirilmiş ve GDF 15 in ineffektif eritropoez durumlarında demir metabolizmasında oynayabileceği role dikkat çekilmiştir. Aynı çalışmada GDF 15 düzeyinin hastalık şiddeti ile ilişkili ola bileceği ve eger böleyse önleyici tedavilerin başlanması zamanı için bir belirteç ola bileceği belirtilmişdir.
Phd. Uzman Dr. Əli Quliyev